El Virus de Inmunodeficiencia Humana (VIH) continúa representando un importante problema de salud pública a nivel mundial. De acuerdo con la Organización Mundial de la Salud (OMS), alrededor de 40 millones de personas viven con VIH al cierre de 2022. En México, el Centro Nacional para la Prevención y el Control del VIH y el Sida (CENSIDA) reportó 240,693 personas con VIH, con una incidencia de 16,941 casos nuevos en 20231,2. El VIH infecta a los linfocitos T CD4, células clave del sistema inmunitario. Sin tratamiento, el recuento de estas células puede descender por debajo de 200 células/mm³, propiciando el desarrollo de enfermedades oportunistas relacionadas con el Síndrome de Inmunodeficiencia Adquirida (SIDA)3.
Aunque no existe una cura para la infección por VIH, se controla mediante una Terapia Antirretroviral (TAR) efectiva, que combina habitualmente tres fármacos4,5. Este esquema reduce de forma significativa la morbilidad y mortalidad, al disminuir la carga viral y elevar el número de linfocitos T CD4, retrasando la progresión de la enfermedad. Además, mantener la carga viral indetectable por al menos seis meses elimina la posibilidad de transmisión sexual del virus (“I=I”: indetectable = intransmisible)6. Gracias a estos avances, la mayoría de las personas que inician TAR oportunamente no progresan hacia el SIDA7
Clases de antirretrovirales
Se han desarrollado múltiples fármacos antirretrovirales agrupados en seis clases terapéuticas, dirigidos a distintas fases del ciclo viral (Fig. 1):
- Inhibidores nucleósidos de la transcriptasa reversa (INTR),
- Inhibidores no nucleósidos de la transcriptasa reversa (INNTR),
- Inhibidores de proteasa (IP),
- Inhibidores de fusión,
- Bloqueadores del correceptor CCR5,
- Inhibidores de integrasa (INI)8,9.
En México, la primera línea de TAR incluye dos INTR como base y un INI, en esquemas alternativos, un INNTR o un IP9. Aun así, puede producirse falla virológica (FV) si la carga viral no se suprime ni se mantiene en niveles indetectables, lo que se asocia frecuentemente con mutaciones de resistencia a los fármacos antirretrovirales10,11.
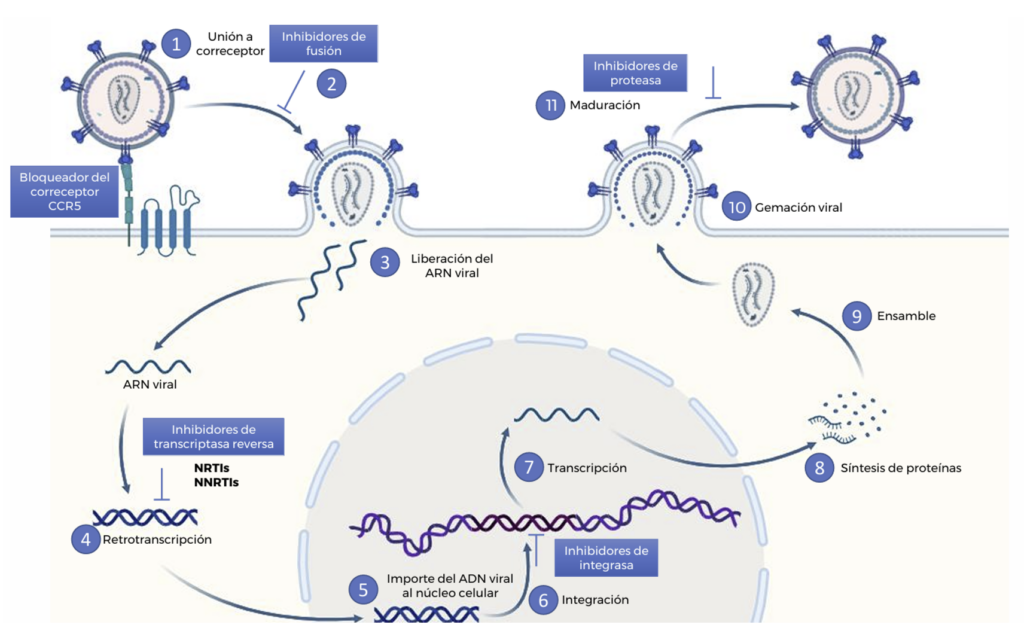
Figura 1. Ciclo viral del VIH y sitios de acción de los antirretrovirales. Unión del virus al receptor CCR5/ CXCR4, 2) Fusión de membranas, 3) Liberación del ARN viral, 4) Retro transcripción al ADN, 5) Entrada al núcleo, 6) Integración en el genoma celular, 7) Transcripción, 8) Síntesis de proteínas, 9) Ensamble, 10) Gemación y 11) Maduración de la partícula viral. En los recuadros azules se indican las clases de fármacos antirretrovirales y su sitio de acción. NRTIs: inhibidores nucleósidos de la transcriptasa reversa, NNRTIs: inhibidores no nucleósidos de la transcriptasa reversa. Fuente: Elaboración propia.
Clases de resistencia
La resistencia a los fármacos antirretrovirales se clasifica en:
- Primaria (transmitida), cuando la persona se infecta con una variante viral ya resistente.
- Secundaria (adquirida), si las mutaciones surgen durante la terapia, bajo la presión de selección de los medicamentos12,13 (Fig. 2).
Tradicionalmente, la detección de estas mutaciones se realizaba mediante la secuenciación de Sanger; sin embargo, en años recientes se ha incrementado el uso de la secuenciación de nueva generación (NGS), capaz de identificar variantes genéticas menores, es decir, presentes en un porcentaje muy bajo de la población viral14,15. Sin embargo, no existe un consenso sobre el umbral mínimo (1%, 2%, 5%, etc.) para considerar una variante como clínicamente relevante hasta el momento16.
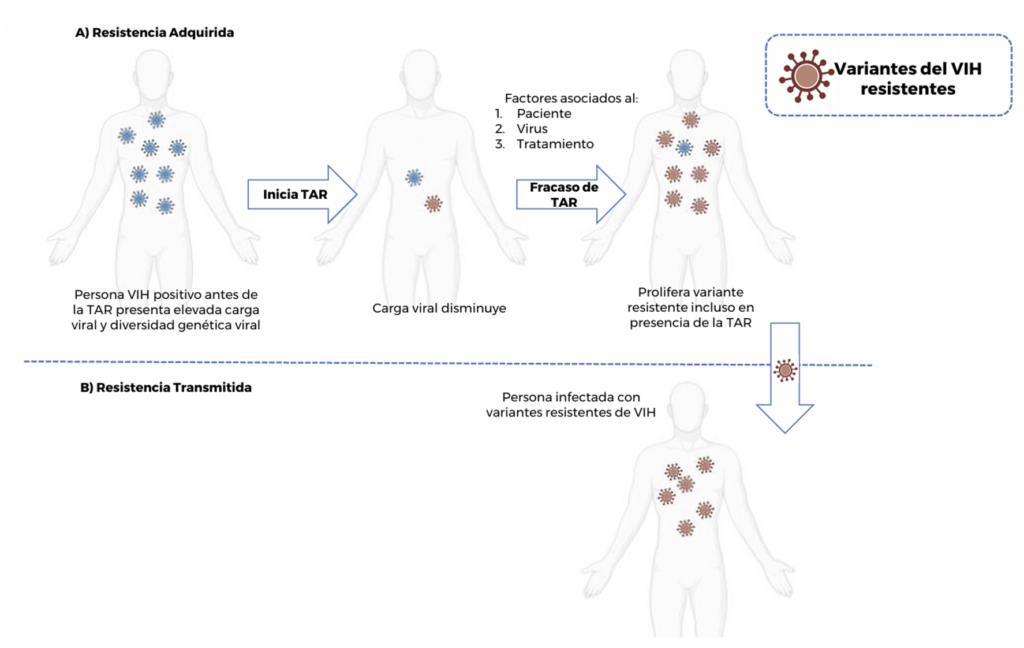
Figura 2. Tipos de resistencia del VIH a los fármacos antirretrovirales. A) Resistencia adquirida: Al iniciar la TAR, la carga viral se reduce, pero puede aparecer resistencia si hay mala adherencia, efectos adversos, potencia subóptima o variantes virales resistentes. Esto conduce a la proliferación de cepas resistentes pese a la terapia. B) Resistencia transmitida: Se presenta cuando la persona adquiere directamente un VIH con mutaciones de resistencia, sin haber recibido TAR previamente. Fuente: Elaboración propia.
Variabilidad genética y detección
En el Instituto Mexicano del Seguro Social (IMSS), las pruebas de resistencia se llevan a cabo principalmente cuando hay FV. Sin embargo, cada vez resulta más pertinente detectarla antes de iniciar el tratamiento, para guiar la mejor elección de fármacos y evitar complicaciones u abandono. En un estudio reciente en el Hospital de Infectología del Centro Médico Nacional “La Raza” (IMSS), se secuenciaron 96 muestras de personas con VIH sin tratamiento previo, enfocándose en los genes Gag y PR. Se observó una alta variabilidad genética (porcentaje de posiciones con cambios respecto a una secuencia de referencia): Gag: 69.2% (1186 sustituciones de aminoácidos en 346 posiciones) y Proteasa (PR): 74.7% (175 sustituciones en 74 de 99 posiciones). Al desglosar las subregiones de Gag, la cápside (p24) mostró el menor porcentaje de sitios con cambios (51.9%), mientras que otras regiones (p2, p7, p1, p17 y p6) presentaron variaciones entre 75% y 92.3%17 (Fig. 3).
Para este estudio, se emplearon umbrales de detección del 1% – 20%. Con un umbral del 1%, se hallaron mutaciones mayores de resistencia a IP en el 8.3% de los pacientes (8 de 96), mientras que con un umbral del 20%, la cifra bajó a 3.1% (3 de 96). Estas cifras se compararon con un estudio previo que reportó 3% (umbral 20%) y 9.5% (umbral 2%) de resistencia18, siendo este último superior al 4.2% reportado en nuestro estudio17. Estas discrepancias podrían atribuirse a errores inherentes de la NGS y a procedimientos bioinformáticos distintos.
La mutación mayor más frecuente fue M46I (3.1% de los casos con umbral 1%), seguida de I54V (2.1% al 20%). También se encontró una amplia gama de mutaciones menores, destacando M36I con 50.0% (48 de 96) al 1% y 19.8% (19 de 96) al 20% de detección. Aunque estas mutaciones menores no suelen causar resistencia por sí solas, pueden potenciarla en combinación con otras variantes. Además, se observó una alta frecuencia de R76K (65.1%), mutación menor asociada FV en el 57% de los casos tratados con IP19 (Fig. 3).
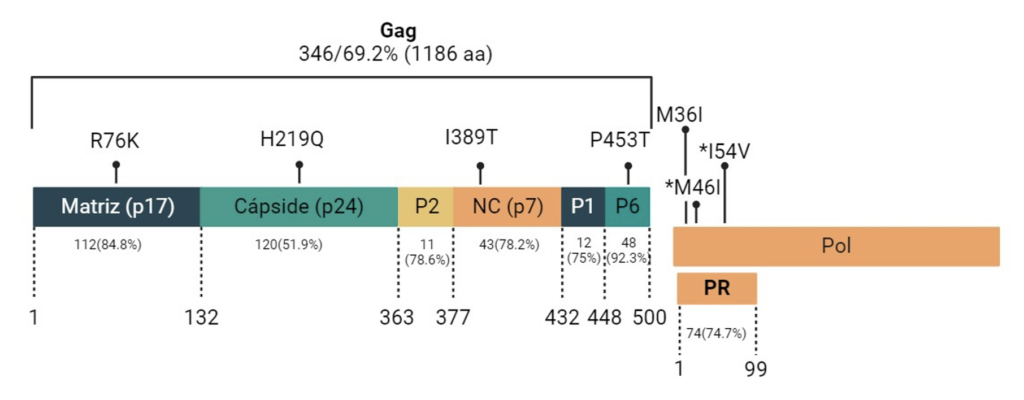
Figura 3. Distribución de mutaciones en Gag y proteasa (PR) del VIH. Se muestra el porcentaje de posiciones con sustituciones en cada subregión de Gag (matriz, cápside, p2, nucleocápside, p1 y p6) y en la PR, así como las mutaciones más representativas (por ejemplo, R76K, M46I e I54V). Fuente: Elaboración propia.
Tendencias internacionales y actualización en México
En 2019, la OMS informó de un aumento importante de farmacorresistencia previa al tratamiento y recomendó limitar el uso de los INNTR en países con niveles altos de resistencia20. A partir de las directrices internacionales para el tratamiento del VIH, se recomiendan el uso de INI, ya que ofrecen buena eficacia y tolerabilidad21. En este sentido, México actualizó en 2019 su política nacional y recomendó regímenes basados en INI de segunda generación como opciones preferentes de primera línea16.
Además, la tecnología NGS está reemplazando gradualmente la secuenciación de Sanger, ya que sus costos han disminuido gracias a la agrupación de muestras y la secuenciación paralela masiva22-23. Sin embargo, todavía persisten desafíos:
- Estandarizar los umbrales de detección de mutaciones.
- Garantizar la calidad de la secuenciación.
- Determinar la relevancia clínica de variantes presentes en baja frecuencia
Conclusión
Optimizar el régimen terapéutico inicial es esencial para lograr un control duradero de la infección por VIH. La caracterización de mutaciones de resistencia antes de iniciar la terapia resulta clave para prevenir cambios posteriores en el tratamiento, mejorar la adherencia y reducir la morbilidad, mortalidad y costos hospitalarios. En el escenario de resistencia creciente, estandarizar y democratizar la detección de variantes mediante NGS es un paso determinante para ofrecer terapias más efectivas y, en última instancia, mejorar la salud y la calidad de vida de las personas con VIH en México.
Agradecimientos
A la Coordinación de Investigación en Salud (CIS) por la revisión y aprobación del proyecto CNIC-R-2017-785-106, y al Fondo de Investigación en Salud “FIS” del IMSS (FIS/IMSS/PROT/ PRIO/18/066) por el financiamiento y al Programa de Investigadoras e investigadores por México (IxM) de la Secihti.